已知,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?A. Cl-浓度增加,使φCl2/Cl减少,H+浓度增加,使φMnO2/Mn2+增加B.两个φΘ相差不大C.酸性增加,使φMnO2/Mn2+减小D.以上三个因素都有
已知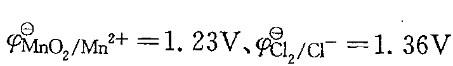 ,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
A. Cl-浓度增加,使φCl2/Cl减少,H+浓度增加,使φMnO2/Mn2+增加
B.两个φΘ相差不大
C.酸性增加,使φMnO2/Mn2+减小
D.以上三个因素都有
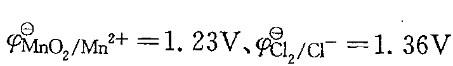 ,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
A. Cl-浓度增加,使φCl2/Cl减少,H+浓度增加,使φMnO2/Mn2+增加
B.两个φΘ相差不大
C.酸性增加,使φMnO2/Mn2+减小
D.以上三个因素都有
参考解析
解析:提示:MnO2与浓盐酸反应生成Cl2的反应式为
MnO2+4HCl=MnCl2+Cl2+2H2O
其中包括两个半反应
(1) MnO2+4H++2e-=Mn2++2H2O
该式的能斯特方程为
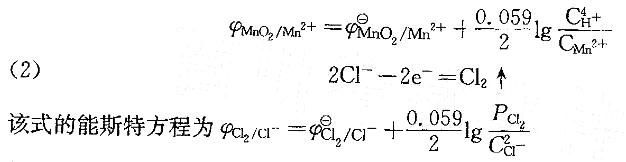
然后根据各自的能斯特方程,分析不同离子的浓度改变时对电极电势的影响。
MnO2+4HCl=MnCl2+Cl2+2H2O
其中包括两个半反应
(1) MnO2+4H++2e-=Mn2++2H2O
该式的能斯特方程为
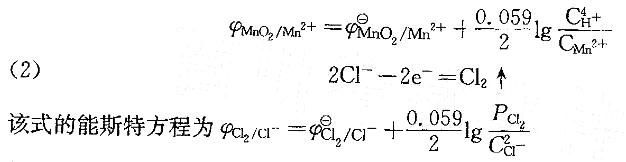
然后根据各自的能斯特方程,分析不同离子的浓度改变时对电极电势的影响。
相关考题:
用间接滴定法测定软锰矿中MnO2时,先加入过量HCl,将生成的过量Cl2通入KI溶液中,最后用Na2S2O3滴定生成的I2,则MnO2与Na2S2O3的计量关系是()。A、1:2B、1:4C、1:1D、2:1
K2Cr2O7(s)与浓H2SO4反应生成的氧化物为(),它为()色,遇酒精立即着火,生成铬的一种()色氧化物,其化学式为()。KMnO4(s)与浓H2SO4作用生成的氧化物为();MnO2与浓H2SO4反应生成的气体是()。
根据标准电极电位,氧化还原反应MnO2+2Cl-+4H+==Mn2++Cl2+2H2O中,MnO2不能氧化Cl-,但用浓盐酸与MnO2作用,可以生成Cl2。下列哪一种解释最不合理:()A、两个电对的标准电极电位相差不大;B、酸度增加,E°(MnO2/Mn2+)增加;C、[Cl-]增加,E°(Cl2/Cl-)减小;D、盐酸浓度增加,氧化还原反应的速率加大。
单选题已知,从标准电极电势看,MnO2不能氧化Cl-,但用MnO2加浓盐酸,可以生成Cl2,这是因为()。A两个相差不大B酸性增强,也增加CCl-浓度增加,减少D以上三个因素都有