专题02 化学计量与化学计算——三年(20202022)高考真题化学分项汇编(全国通用)(原卷版)
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
D.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,2.24LH2O含有的分子数等于0.1NA
B.常温下, 溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4 中含N—H键数目为
下列说法不正确的是()。
A.阿伏加德罗常数L=6.022×1023mmol-1
B.1molHCL所含的离子数目是6.022×1023个
C.1molHCL所含的分子数目是6.022×1023个
D.1molHCL所含的分子数目与0.012kgC12所包含的原子数目相等。
下列说法正确的是()。
A.阿伏加德罗常数L=6.022×1020mol-1
B.1molHCL所含的离子数目是6.022×1023个
C.1molHCL所含的分子数目是6.022×1023个
D.1molHCL所含的分子数目与0.012kgC12所包含的原子数目相等。

专题02 化学计量与化学计算1(2022全国甲卷)为阿伏加德罗常数的值,下列说法正确的是( )A,下,氢气中质子的数目为B溶液中,的数目为C苯甲酸完全燃烧,生成的数目为D电解熔融,阴极增重,外电路中通过电子的数目为2(2022浙江卷)为阿伏加德罗常数的值,下列说法正确的是A中含有个阳离子B乙烷和丙烯的混合气体中所含碳氢键数为C含有中子数为D和于密闭容器中充分反应后,分子总数为3(2022广东卷)我国科学家进行了如图所示的碳循环研究。下列说法正确的是A淀粉是多糖,在一定条件下能水解成葡萄糖B葡萄糖与果糖互为同分异构体,都属于烃类C中含有个电子D被还原生成4(2022浙江卷)联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:,石灰石分解需要的能量由焦炭燃烧提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成,其热量有效利用率为50%。石灰窑中产生的富含的窑气通入氨的氯化钠饱和溶液中,40%的最终转化为纯碱。已知:焦炭的热值为(假设焦炭不含杂质)。请回答:(1)每完全分解石灰石(含,杂质不参与反应),需要投料_kg焦炭。(2)每生产106kg纯碱,同时可获得_(列式计算)。5(2021全国高考甲卷)为阿伏加德罗常数的值。下列叙述正确的是A重水()中含有的质子数为B的与完全反应时转移的电子数为C环状()分子中含有的键数为D的溶液中离子数为6(2021广东)设为阿伏加德罗常数的值。下列说法正确的是A含有键的数目为B的盐酸含有阴离子总数为C与混合后的分子数目为D与足量反应生成的分子数目为7(2021河北)NA是阿伏加德罗常数的值,下列说法错误的是A22.4L(标准状况)氟气所含的质子数为18NAB1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2NAC电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为NAD1L1molL-1溴化铵水溶液中NH与H+离子数之和大于NA8(2021湖南)为阿伏加德罗常数的值。下列说法正确的是A含有的中子数为B溶液中含有的数为C与在密闭容器中充分反应后的分子数为D和(均为标准状况)在光照下充分反应后的分子数为9(2021浙江)设为阿伏加德罗常数的值,下列说法不正确的是A标准状况下,中含有中子数为B(分子结构:)中的共价键数目为C的水溶液中含有氧原子数为D三肽(相对分子质量:189)中的肽键数目为10(2021浙江)设NA为阿伏加德罗常数的值,下列说法正确的是A1 mol NH4F晶体中含有的共价键数目为3NABCH4和C2H4混合气体2.24L(标准状况)完全燃烧,则消耗O2分子数目为0.25NAC向100mL 0.10molL-1FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NAD0.1 mol CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA11.(2021福建) 设为阿伏加德罗常数的值.下列说法正确的是A. 所含极性共价键的数目为B. 晶体中阴、阳离子总数为C. 与足量反应生成的分子数为D. 电解熔融制,电路中通过的电子数为12.(2021海南) 代表阿伏加德罗常数的值。下列说法正确的是A. 中含有的电子数为1.3B. 中含有的共价键的数目为0.1C. 肼含有的孤电子对数为0.2D. ,生成乙烷时断裂的共价键总数为13.(2021湖北) NA为阿伏加德罗常数的值。下列说法错误的是A. 23gCH3CH2OH中sp3杂化的原子数为NAB. 0.5molXeF4中氙的价层电子对数为3NAC. 1molCu(H2O)42+中配位键的个数为4NAD. 标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA14.(2021天津)设NA为阿伏加德罗常数的值,下列叙述正确的是A. 1mol/LHCl溶液中,HCl分子的数目为NAB. 22.4L氢气中,H2分子的数目为NAC. 180g葡萄糖中,C原子的数目为6NAD. 1molN2中,键的数目为3NA152020新课标NA是阿伏加德罗常数的值。下列说法正确的是A22.4 L(标准状况)氮气中含有7NA个中子B1 mol重水比1 mol水多NA个质子C12 g石墨烯和12 g金刚石均含有NA个碳原子D1 L 1 molL1 NaCl溶液含有28NA个电子162020浙江7月选考为阿伏加德罗常数的值。下列说法正确的是( )A,完全反应转移的电子数为B用电解粗铜的方法精炼铜,当电路中通过的电子数为时,阳极应有转化为C常温下,的溶液中,水电离出的数为D浓度为的溶液中,阴离子数为17.(2020浙江卷)溶液与锌粉在量热计中充分反应。测得反应前温度为,反应后最高温度为。已知:反应前后,溶液的比热容均近似为、溶液的密度均近似为,忽略溶液体积、质量变化和金属吸收的热量。请计算:(1)反应放出的热量_J。(2)反应的_(列式计算)。182020江苏卷溶液与锌粉在量热计中充分反应。测得反应前温度为,反应后最高温度为。已知:反应前后,溶液的比热容均近似为、溶液的密度均近似为,忽略溶液体积、质量变化和金属吸收的热量。请计算:(1)反应放出的热量_J。(2)反应的_(列式计算)。



B.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA
C.标准状况下,1.12 L甲醇中碳原子的数目为0.05NA
D.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
B.1 mol的羟基与1mol的氢氧根离子所含电子数均为9NA
C.25℃时,1 L pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
B.常温常压下,2 mol氦气所具有的原子数目为2NA
C.1L 0.2 mol·L-1的Na2S溶液中,S2-的数目为0.2NA
D.1mol Cl2与足量的Fe完全反应转移的电子数目为3NA
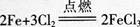 铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。
铁从0价变为+3价,l mol铁失去3 mol电子,转移电子数为N=n×NA=3XNA=3NA,但需1.5 m01氯气,所以1mol Cl2与足量的铁反应,电子转移依据氯气计算,转移电子数为2 mol,电子数为N=n×M=2×NA=2NA,D项错误。
B.标准状况下,11.2 L甲醛气体中电子数为8NA个
C.常温常压下,7.8 9苯中含有单键的数目为0.9NA
D.1 L浓度为1 mol.L-1,的Na2C03溶液中含有CO32-的数目为NA个
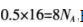 B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。
B项正确:C项.在苯中不存在C—C单键,C项错误;D项,碳酸根离子会发生水解,故碳酸钠溶液中含有的碳酸根的数目小于NA,D项错误。相关考题:
- 疟疾俗称为“打摆子”。
- 应用下列哪种栓塞材料后,侧支循环难以建立()A、不锈钢圈B、明胶海绵C、微球D、血凝块E、球囊
- 慢性纤维化肺病多见于长期接触--而致()A、二氧化硅B、锰烟C、木尘D、二氧化硫E、锌烟
- 睡眠多导描记仪可自动记录患者的( )A、眼电图B、脑电图C、肌电图D、血氧饱和度E、心电图
- 疟疾与急性上呼吸道感染的鉴别要点有哪些?
- 敏感株所引起的间日疟,其病因治疗最佳方案是联合应用()、()。
- 下列对睾丸结构描述错误的是()。A、睾丸实质表面纤维膜称白膜B、白膜增厚向内延伸形成睾丸纵隔C、睾丸纵隔内有睾丸网和血管D、精曲小管位于睾丸小叶内E、精直小管上皮能生成精子
- 疟疾发生的高峰期是什么时候。()A、三、四月份五B、五、六月份C、八、九月份
- 居民疟原虫率调查在流行程度较低时很不敏感,通常以发热病人血检或血清学调查替代。
- 女性,3岁。出生后右面部有一红色、界限清晰的斑块,不高出皮面,压之能褪色。斑块随年龄增长而增大。以下治疗措施最恰当的是()A、激光治疗B、放射治疗C、硬化剂治疗D、激素疗法E、手术疗法