某温度时,已知0.100mol/dm3氢氰酸(HCN)的电离度为0. 010%,该温度时HCN的标准电离常数是:A. 1.0X10-5B. 1.0X10-4C. 1.0X10-9D. 1.0X10-6
某温度时,已知0.100mol/dm3氢氰酸(HCN)的电离度为0. 010%,该温度时HCN的标准电离常数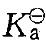 是:
是:
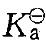 是:
是:
A. 1.0X10-5
B. 1.0X10-4
C. 1.0X10-9
D. 1.0X10-6
B. 1.0X10-4
C. 1.0X10-9
D. 1.0X10-6
参考解析
解析:提示:电离度a与电离常数的关系:Ka=Ca2/(1-a)。
相关考题:
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:A.该溶液的pH=4B.升高温度,溶液的pH增大C.此酸的电离平衡常数约为1×10-7D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
某酸在18℃时的平衡常数为1.84*10-5,在25℃时的平衡常数为1.87*10-5,则说明该酸()。 A.在18℃时溶解度比25℃小B.的电离过程是吸热过程C.温度高时电离度变小D.温度高时溶液中的氢离子浓度变小
电离度和电离平衡常数都是表示弱电解质的相对强弱,它们之间的关系是( )。A.电离度越大,电离平衡常数越大B.浓度越稀,电离度越大,电离平衡常数越大C.在相同的温度下电离度可变,而电离平衡常数不变D.多元弱酸的每一步电离平衡常数是相同的
在某温度时,已知0.100 mol/dm3的氢氰酸(HCN)的电离度为0.010%,该温度时HCN的标准电离常数是:(A)1.0 ×10?5(B)1.0 ×10?4(C)1.0 ×10?9 (D)1.0 ×10?6
某温度时,已知0.100mol/dm3氢氰酸(HCN)的电离度为0. 010%,该温度时HCN的标准电离常数是:A. 1.0X10-5 B. 1.0X10-4 C. 1.0X10-9 D. 1.0X10-6
某酸在18℃时的平衡常数为1.84×10-5,在25℃时的平衡常数为1.87×10-5,则说明该酸()。A、在18℃时溶解度比25℃时小B、的电离是一个吸热过程C、温度高时电离度变小D、温度高时溶液中的氢离子浓度变小
已知:Kθ(HCN)=6.2×10-10,Kθ(NH3·H2O)=1.8×10-5。则反应NH3+HCN→NH4++CN-的标准平衡常数等于()。A、0.90B、1.1C、9.0×10-5D、9.0×10-19
已知在298015K时,下列反应的标准平衡常数: HCN=H++CN- Kθa=4.93×10-10 NH3+H2O = NH4+ +OH- Kθb=4.93×10-10 H2O = H++OH- Kθw=4.93×10-10 下列反应的标准平衡常数Kθ是() NH3 + HCN = NH4++CN-A、8.82×10-29B、2.75×10-19C、8.82×10-1
在某温度时,下列溶液体系中属缓冲溶液的是:()A、0.100mol/dm3的NH4Cl溶液B、0.100mol/dm3的NaAC溶液C、0.400mol/dm3的HCl与0.200mol/dm的NH3·H2O等体积混合后的溶液D、0.400mol/dm3的NH3H2O与0.200mol/dm3的HCL等体积混合后的溶液
单选题电离度和电离平衡常数都是表示弱电解质的相对强弱,它们之间的关系是()。A电离度越大,电离平衡常数越大;B浓度越稀,电离度越大,电离平衡常数越大;C在相同的温度下电离度可变,而电离平衡常数不变;D多元弱酸的每一步电离平衡常数是相同的
单选题某碱在18℃时的平衡常数为1.84×10-5,在25℃时的平衡常数为1.87×10-5,则说明该碱()。A在18℃时溶解度比25℃时小B的电离是一个放热过程C温度高时电离度变大D温度低时溶液中的氢氧根离子浓度变大
单选题某酸在18℃时的平衡常数为1.84×10-5,在25℃时的平衡常数为1.87×10-5,则说明该酸()。A在18℃时溶解度比25℃时小B电离是一个放热过程C温度高时电离度变大D温度低时溶液中的氢离子浓度变大