电极相同、电解质也相同的两个半电池,都可以进行电极反应,但溶液的浓度不同,则它们组成的电池的电动势是( )。
电极相同、电解质也相同的两个半电池,都可以进行电极反应,但溶液的浓度不同,则它们组成的电池的电动势是( )。

参考解析
解析:

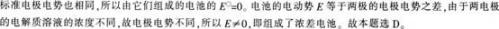

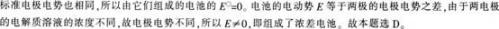
相关考题:
关于参比电极的描述,正确的是()A、参比电极与测量电极在电解质溶液中构成一个测量原电池B、参比电极是原电池里的半电池C、参比电极所产生的电位随被测溶液的浓度变化而变化D、测量电极产生测量误差,参比电极不产生测量误差
关于电动势,下列说法不正确的是哪个?()A、电动势的大小表明了电池反应的趋势B、电动势的大小表征了原电池反应所做的最大非体积功C、某些情况下电动势的值与电极电势值相同D、标准电动势小于零时,电池反应不能进行
有下列两个电池(c1<c2)a:Cu(s)|Cu2+(c1)‖Cu2+(c2)|Cu(s)b:Pt|Cu2+(c1),Cu+(c3)‖Cu2+(c2),Cu+(c3)|Pt它们的电池反应与电动势a和b之间的关系为()A、电池反应相同,a=bB、电池反应不同,a=bC、电池反应相同,a=2bD、电池反应相同,a=(1/2)b
用pH玻璃电极与饱和甘汞电极组成电池,当标准液的pH=4.0时,测得电池电动势为-0.14V,于同样的电池中放入未知pH值的溶液,测得电动势为0.02V,则未知液的pH值为()A、7.6B、6.7C、5.3D、3.5
两个半电池,电极相同,电解后溶液中各物质相同,都可以进行电极反应,但溶液浓度不同,将两个半电池用盐桥和导线联接,这个电池的电动势()A、εΘ= 0, ε = 0B、εΘ= 0, ε ≠ 0C、εΘ≠ 0, ε = 0D、εΘ≠ 0, ε ≠ 0
为了测量双液电池的电动势,在两电极之间需要用盐桥来联接,在下列各种溶液中可作盐桥溶液的是()A、 可溶性惰性强电解质溶液B、 正负离子的扩散速度几乎相同的稀溶液C、 正负离子的扩散速度几乎相同的浓溶液D、 正负离子的扩散速度接近, 浓度较大的惰性盐溶液
在“标准电极电势表”中列出的电极电势E°都是指25℃时该电极反应中各物质活度均为1时相对于标准氢电极电势之值。为了精确测定诸电极的E°值,下列方法(均在25℃下进行)可行的是()A、精确配制出各电极活性物质的活度为1的溶液组成电池,测定电池的电动势B、由电解质活度、电解质离子平均活度及与它们相应的浓度之间的关系,求得电解质活度为1时的浓度,以此配制电解液,进行电动势测量C、由实验测定热力学数据(如ΔG°f ), 然后计算E°D、配制浓度不同的一系列电解质溶液,测出待定电极与标准氢电极组成的电池的一系列电动势E值,用外推法求出E°
单选题用pH玻璃电极与饱和甘汞电极组成电池,当标准液的pH=4.0时,测得电池电动势为-0.14V,于同样的电池中放入未知pH值的溶液,测得电动势为0.02V,则未知液的pH值为()A7.6B6.7C5.3D3.5
多选题热力学上对标准氢电极的半电池反应的热力学数据进行了规定:()A标准氢电极的半电池反应的吉布斯自由能变在任何温度下都是0;B标准氢电极的电极电位在任何温度下都是0;C标准氢电极的半电池反应的焓变在任何温度下都为0;D标准氢电极的半电池反应的熵变在任何温度下都为0;E标准氢电极中氢离子的活度为1。
填空题电位法测量常以()作为电池的电解质溶液,浸入两个电极,一个是指示电极,另一个是参比电极,在零电流条件下,测量所组成的原电池()。