高考化学真题与模拟类编专题水溶液中的离子平衡含答案资 料
此题为判断题(对,错)。
此题为判断题(对,错)。
用氢氧化钠滴定液(0. 1000mol/L)滴定20. 00ml盐酸溶液(0.l000mol/L),滴定突跃范围的pH值是
A、1. 00~3.00
B、3.00~4.30
C、4. 30~9.70
D、8.00~9.70
E、9. 70 ~10. 00
氧化还原滴定曲线是溶液的E值和离子浓度的关系曲线。
此题为判断题(对,错)。
此文档来源于网络,如有侵权请联系网站删除只供学习交流用1【 2018 新课标 3卷】用 0. 100 molL-1AgNO3滴定 50. 0 mL 0.0500 molL-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是A根据曲线数据计算可知Ksp(AgCl ) 的数量级为 10-10B曲线上各点的溶液满足关系式c( Ag+)c( Cl-)= Ksp( AgCl ) C相同实验条件下,若改为0. 0400 molL-1Cl-,反应终点c 移到 aD相同实验条件下,若改为0. 0500 molL-1Br-,反应终点c 向 b 方向移动【答案】 C【解析】分析:本题应该从题目所给的图入手,寻找特定数据判断题目中的沉淀滴定的具体过程。注意:横坐标是加入的硝酸银溶液的体积,纵坐标是氯离子浓度的负对数。C滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL 0. 05mol/ L 的 Cl-溶液改为 50mL 0.04mol / L 的 Cl-溶液,此时溶液中的氯离子的物质的量是原来的 0. 8 倍,所以滴定终点需要加入的硝酸银的量也是原来的0. 8 倍,因此应该由c 点的25mL 变为2018 年高考试题精品资料 - - - 欢迎下载 - - - - - - - - - - - 欢迎下载 名师归纳 - - - - - - - - - -第 1 页,共 20 页 - - - - - - - - - - 此文档来源于网络,如有侵权请联系网站删除只供学习交流用250. 8=20mL ,而 a点对应的是15mL,选项 C 错误。点睛:本题虽然选择了一个学生不太熟悉的滴定过程沉淀滴定,但是其内在原理实际和酸碱中和滴定是一样的。这种滴定的理论终点都应该是恰好反应的点,酸碱中和滴定是酸碱恰好中和,沉淀滴定就是恰好沉淀,这样就能判断溶液发生改变的时候,滴定终点如何变化了。2【 2018 北京卷】测定0. 1 molL-1Na2SO3溶液先升温再降温过程中的pH,数据如下。时刻温度/ 25304025pH9. 669. 529. 379. 25实验过程中,取时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,产生白色沉淀多。下列说法不正确的是ANa2SO3溶液中存在水解平衡:+H2O+OH-B的 pH 与不同,是由于浓度减小造成的C的过程中,温度和浓度对水解平衡移动方向的影响一致D与的 Kw值相等【答案】 C【解析】分析:A 项, Na2SO3属于强碱弱酸盐,SO32-存在水解平衡;B 项,取时刻的溶液,加入盐酸酸化的 BaCl2溶液做对比实验,产生白色沉淀多,说明实验过程中部分Na2SO3被氧化成Na2SO4,与温度相同,与对比,SO32-浓度减小,溶液中c(OH-) ,的 pH 小于; C 项,盐类水解为吸热过程,的过程,升高温度SO32-水解平衡正向移动,c(SO32-)减小,水解平衡逆向移动;D项, Kw只与温度有关。详 解 : A项 , Na2SO3属 于 强 碱 弱 酸 盐 , SO32-存 在 水 解 平 衡 : SO32-+H2OHSO3-+OH-、HSO3-+H2OH2SO3+OH-,A 项正确; B 项,取时刻的溶液,加入盐酸酸化的BaCl2溶液做对比精品资料 - - - 欢迎下载 - - - - - - - - - - - 欢迎下载 名师归纳 - - - - - - - - - -第 2 页,共 20 页 - - - - - - - - - - 此文档来源于网络,如有侵权请联系网站删除只供学习交流用实验,产生白色沉淀多,说明实验过程中部分Na2SO3被氧化成 Na2SO4,与温度相同,与对比, SO32-浓度减小,溶液中c(OH-) ,的pH 小于,即的pH 与不同,是由于SO32-浓度减小造成的, B 项正确; C 项,盐类水解为吸热过程,的过程,升高温度SO32-水解平衡正向移动,c(SO32-)减小,水解平衡逆向移动,温度和浓度对水解平衡移动方向的影响相反,C 项错误; D 项,Kw只与温度有关,与温度相同,Kw值相等;答案选C。点睛:本题考查盐类水解离子方程式的书写、外界条件对盐类水解平衡的影响、影响水的离子积的因素、SO32-的还原性。解题时注意从温度和浓度两个角度进行分析。3【 2018 天津卷】 LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的 pH 随 c初始( H2PO4)的变化如图 1所示,H3PO4溶液中 H2PO4的分布分数 随 pH 的变化如图2 所示,下列有关 LiH2PO4溶液的叙述正确的是A溶液中存在3 个平衡B含 P 元素的粒子有H2PO4、HPO42、PO43C随 c初始(H2PO4)增大,溶液的pH 明显变小D 用浓度大于1 molL-1的 H3PO4溶液溶解 Li2CO3, 当 pH 达到 4. 66时, H3PO4几乎全部转化为LiH2PO4【答案】 D【解析】分析:本题考查电解质溶液的相关知识。应该从题目的两个图入手,结合磷酸的基本性质进行分析。D由图 2 得到, pH=4. 66 的时候, =0. 994,即溶液中所有含P 的成分中H2PO4占 99. 4% ,所以此时精品资料 - - - 欢迎下载 - - - - - - - - - - - 欢迎下载 名师归纳 - - - - - - - - - -第 3 页,共 20 页 - - - - - - - - - - 此文档来源于网络,如有侵权请联系网站删除只供学习交流用H3PO4几乎全部转化为LiH2PO4。选项 D 正确。点睛:本题中随着c初始(H2PO4)增大,溶液的pH 有一定的下降,但是达到一定程度后就基本不变了。主要是因为 H2PO4存在电离和水解,浓度增大电离和水解都会增加,影响会互相抵消。4【 2018 天津卷】下列叙述正确的是A某温度下,一元弱酸HA 的 Ka越小,则 NaA 的 Kh( 水解常数 ) 越小B铁管镀锌层局部破损后,铁管仍不易生锈C反应活化能越高,该反应越易进行D不能用红外光谱区分C2H5OH 和 CH3OCH3【答案】 B【解析】分析:本题是对化学理论进行的综合考查,需要对每一个选项的理论表述进行分析,转化为对应的化学原理,进行判断。D红外光谱是用来检测有机物中的官能团或特定结构的,C2H5OH 和 CH3OCH3的官能团明显有较大差异,所以可以用红外光谱区分,选项D 错误。点睛:反应的活化能是指普通分子达到活化分子需要提高的能量,则活化能越大,说明反应物分子需要吸收的能量越高(即,引发反应需要的能量越高),所以活化能越大,反应进行的就越困难。从另一个角度理解,课本中表述为,活化能越大,反应的速率应该越慢,这样也可以认为活化能越大,反应越困难。5【 2018 江苏卷】根据下列图示所得出的结论不正确的是精品资料 - - - 欢迎下载 - - - - - - - - - - - 欢迎下载 名师归纳 - - - - - - - - - -第 4 页,共 20 页 - - - - - - - - - - 此文档来源于网络,如有侵权请联系网站删除只供学习交流用A图甲是 CO( g)+ H2O( g)CO2( g)+ H2(g) 的平衡常数与反应温度的关系曲线,说明该反应的 H c(H2C2O4 ) c( C2O42- ) c( H+ ) CpH = 7 的溶液: c(Na+ ) = 0. 1000 molL-1+ c( C2O42-) - c( H2C2O4) Dc( Na+ ) = 2c(总) 的溶液: c( OH-) - c(H+) = 2c(H2C2O4) + c( HC2O4-) 【答案】 AD详解: A 项,H2C2O4溶液中的电荷守恒为c(H+)=c(HC2O4-)+2c( C2O42-)+c(OH-) ,0. 1000 molL- 1H2C2O4溶液中 0. 1000mol/ L=c (H2C2O4) + c (HC2O4-) + c (C2O42-) , 两式整理得c (H+) =0. 1000mol/ L- c(H2C2O4)+c(C2O42-)+c(OH-) ,A 项正确; B 项, c(Na+)=c(总 )时溶液中溶质为NaHC2O4,HC2O4-既存在电离平衡又存在水解平衡,HC2O4-水解的离子方程式为HC2O4-+H2OH2C2O4+OH-,HC2O4-水解常数精品资料 - - - 欢迎下载 - - - - - - - - - - - 欢迎下载 名师归纳 - - - - - - - - - -第 6 页,共 20 页 - - - - - - - - - - 此文档来源于网络,如有侵权请联系网站删除只供学习交流用Kh=1.8510-13Ka2(H2C2O4) , HC2O4-的电离程度大于水解程度,则c(C2O42-)c(H2C2O4) ,B 项错误; C 项,滴入 NaOH 溶液后,溶液中的电荷守恒为c(Na+)+c(H+) =c(HC2O4-)+2c(C2O42-)+c( OH-) ,室温pH=7 即 c(H+)=c(OH-) ,则 c(Na+)=c(HC2O4-)+2c(C2O42-)=c(总) +c( C2O42-)- c(H2C2O4) ,由于溶液体积变大,c(总)0. 1000mol / L,c(Na+)0. 1000mol/ L + c(C2O42-)- c(H2C2O4) ,C项错误; D 项, c(Na+)=2c(总)时溶液中溶质为Na2C2O4,溶液中的电荷守恒为c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) ,物料守恒为c (Na+)=2 c (H2C2O4) + c(HC2O4-)+ c ( C2O42-) ,两式整理得c(OH-)- c(H+)=2c(H2C2O4)+c(HC2O4-) ,D 项正确;答案选AD 。点睛:本题考查溶液中粒子浓度的大小关系。确定溶液中粒子浓度大小关系时,先确定溶质的组成,分析溶液中存在的平衡,弄清主次(如B 项) ,巧用电荷守恒、物料守恒和质子守恒(质子守恒一般可由电荷守恒和物料守恒推出) 。注意加入NaOH 溶液后,由于溶液体积变大,c(总)0. 1000mol/ L。7 【 2018 届扬州市三模】向湿法炼锌的电解液中同时加入Cu 和 CuSO4,可生成CuCl 沉淀除去Cl,降低对电解的影响,反应原理如下:Cu( s)+Cu2+( aq)2Cu+( aq) H1a kJmol-1Cl( aq)+ Cu+( aq)CuCl( s) H2b kJmol-1实验测得电解液pH 对溶液中残留c( Cl) 的影响如图所示。下列说法正确的是A向电解液中加入稀硫酸,有利于Cl-的去除B溶液 pH 越大, Ksp(CuCl) 增大C反应达到平衡增大c(C、u2+) ,c( Cl) 减小DCu( s)+Cu2+( aq)+Cl(aq)CuCl(s)的 H ( a+2b)kJmol-12018届高考模拟试题精品资料 - - - 欢迎下载 - - - - - - - - - - - 欢迎下载 名师归纳 - - - - - - - - - -第 7 页,共 20 页 - - - - - - - - - - 此文档来源于网络,如有侵权请联系网站删除只供学习交流用【答案】 C【解析】分析:A根据图像分析pH 与氯离子浓度的关系;B根据溶度积常数只与温度有关系;C根据外界条件对平衡的影响分析;D根据盖斯定律计算。详解: A根据图像,溶液的pH 越小,溶液中残留c( Cl) 越大,因此向电解液中加入稀硫酸,不利于Cl-的去除, A 错误;BKsp( CuCl) 只与温度有关,与溶液pH 无关, B 错误;C根据Cu( s)+ Cu2+( aq)2Cu+( aq) 可知增大c( Cu2+) ,平衡正向移动,使得c( Cu+) 增大,促进Cl( aq)+ Cu+( aq)CuCl( s) 右移, c(Cl) 减小, C 正 确;D已知 Cu(s)+Cu2+
[109—110]
A.炽灼残渣
B.酸度
C.生育酚
D.正己烷
E.溶液的澄清度
以下维生素E检查方法所对应的检查项目是
109.取供试品1.0g,加乙醇和乙醚各15ml,用氢氧化钠滴定液(0.1mol/L)滴定,消耗氢氧化钠滴定液不得超过0. 5ml
110.取供试品0.10g,加无水乙醇5ml溶解后,加二苯胺试液l滴,用硫酸铈滴定液(0.01mol/L)滴定,不得超过1.0ml
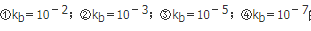
的弱碱溶液,得到四条滴定曲线,其中滴定突跃最长的是( )。
B. ②
C. ③
D. ④

得到四条滴定曲线,其中滴定突跃最小的是( )。
B. ②
C. ③
D. ④
A.磺胺嘧啶 B..硫酸阿托品
C.盐酸麻黄碱 D..丙酸睾酮
E.罗红霉素
解答:用此方法来测定生物碱类药物,其中硫酸盐和磷酸盐不加醋酸汞溶液,硝酸盐则采用电位法来指示终点,氢卤酸盐则须加醋酸汞溶液以消除卤离子的干扰。磺胺类药物采用重氮偶合反应来测定含量,甾体激素类药物通常采用HPLC法来测定含量,罗红霉素和庆大霉素采用抗生素生物检定法来测定效价,而青霉素采用紫外分光光度法(硫醇汞盐法)和头孢类及美他环素采用HPLC法来测定含量。
A.8.72 B. 7.00
C. 5.27 D. 4.30
E.3.50
相关考题:
- 根据《环境影响评价技术导则-总纲》,对于环境质量和区域污染源现状调查,对选定的评价因子及各环境要素的质量现状评价采用什么方法进行。()A、单因子污染指数法或相关标准规定的评价方法B、单因子污染指数法C、单因子标准指数法或相关标准规定的评价方法D、等标污染指数法
- 装置的停车按性质一般可分为全局性紧急停车,()和正常停车。A、紧急停车B、异常停车C、局部停车D、突然停车
- 辩手的气质与风度与其选择的立场息息相关。
- 宫颈黏液检查的目的是()A、诊断宫颈炎症B、确定宫颈病变性质C、评价卵巢功能,预测排卵D、用于宫颈相关病变和相关疾病的观察
- 评价废水可生化性的重要指标是()。A、COD/DOB、TOC/CODC、DO/TOCD、BOD5/COD
- 下列错误表述“侔”的作用的是()A、做并列,丰富内容B、做对比,强调同异C、做援引,产生共鸣D、做排比,加强情感
- 输卵管结扎应用最广泛的方法是()A、输卵管银夹法B、输卵管折叠结扎切除法C、抽心包埋法D、普氏改良法
- 新生儿和婴儿骨髓穿刺的位置是()A、髂前上棘B、髂后上棘C、胫骨D、胸骨
- 请问四肢外伤时动脉出血有什么特点?
- 总结陈词本场总结和()两个方面。A、告别总结B、自己观点总结C、批判攻击D、超越升华
- 福建师范大学2022年8月课程考试《学前儿童语言教育》作业考核-
- 福建师范大学2022年8月课程考试《大学语文(二)》作业考核-
- 福建师范大学2022年8月课程考试《大学英语(2)》作业考核-
- 福建师范大学2022年8月课程考试《公共管理学》作业考核-
- 福建师范大学2022年8月课程考试《项目评估》作业考核-
- 福建师范大学2022年8月课程考试《中外美术史》作业考核试题-
- 福建师范大学2022年8月课程考试《形势与政策公共课》作业考核5-
- 福建师范大学2022年8月课程考试《应用写作》作业考核-
- 福建师范大学2022年8月课程考试《大学语文(一)》作业考核-
- 福建师范大学2022年8月课程考试《商法》作业考核-