河南省漯河市第五高级中学20152016学年高一化学上学期9月月考试题
可能用到的相对原子质量:H 1 C 12 0 16 Na 23 Mg 24 Al 27 Cl 35.5
1.(2009?重庆)下列变化中属于化学变化的是( )
A.木柴劈成块 B.西瓜榨成汁 C.残雪化成水 D.高粱酿成酒
可能用到的相对原子质量H—1 C—12 O—16 Mg—24 Cl—36.5
1、 日常生活中发生的下列变化,属于化学变化的是( )
A. 水结成冰 B。纸张燃烧 C 玻璃破碎 D 汽油挥发
下列离子方程式正确的是
A. 向盐酸中滴加氨水:H+ + OH- = H2O
B. Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C. 铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
【解析】A项中的氨水应写成分子式,B项发生的是氧化还原反应;C项正确;氯气具有强氧化性将S2O32-氧化成SO42-,正确的离子方程式应为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故D错。
【考点分析】考查离子方程式的正误判断。
可能用到的相对原子质量:H—1,C—12,N—14,O—16,Na—23,Mg—24,Al—27,S—32,Cl—35.5,Ca—40,Fe—56,Zn—65,Ag—108
1.下列变化中属于化学变化的是
A.榨取果汁 B.粉碎废纸 C.燃放烟花 D.切割玻璃
可能用到的相对原子质量:H—1 C—12 N—1 O—16 Na—23 Cl—35.5 Ca—40
1.为加快建成“资源节约型城市”,苏州市推出多项措施,其中不属于“节能减排”的是
A.禁止生产、设计和使用粘土实心砖,以节约土壤资源
B.“龙芯”绿色节能电脑引入苏州常熟百所学校
C.加拿大太阳能有限公司将在苏州新区安装太阳能发电设备
D.优先大力发展城市公共交通,以减少小轿车尾气排放
20152016(上)高一九月考试化学试题 (90分钟,100分)可能用到的相对原子质量H:1 He:4 C:12 N:14 O:16 Na:23 Al:27 S:32 Cl:35.5K:39 Ca:40 Fe:56 Cu:64 Ag:108 一单项选择题(30个小题,每小题2分,共60分)1天津港“812”瑞海公司危险品仓库特别重大火灾爆炸事故造成重大人员伤亡和财产损失,危险化学品的储存与运输成为社会关注的焦点,事故新闻报道中多次出现的NaCN(氰化钠)的外包装应有下列哪种标识() A 2.下列溶液中,与100mL 0.5mol/L NaCl溶液所含的Cl物质的量浓度相同的是( ) A100mL 0.5mol/L MgCl2溶液 B200mL 0.25mol/L AlCl3溶液 C50ml 1mol/L NaCl溶液 D25ml 0.5mol/L HCl溶液3.下列实验操作中不正确的是( )A蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 B定容时,如果加水超过了刻度线,可用蒸发皿蒸出少量水后重新定容C配制稀硫酸时,先在烧杯中加入一定量水,再沿玻璃棒慢慢加入浓硫酸D称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,砝码放在右盘4.科学家已发现一种新型氢分子,其化学式为在相同温度和压强下,等质量的和具有相同的是( ) A.原子数 B.分子数 C.体积 D.物质的量 5.设NA为阿伏加德罗常数的值,下列说法不正确的是( )A常温常压下,23g NO2含有NA个氧原子B常温常压下,18mL H2O约含有NA个H2O分子 C含14 NA个电子的N2分子的物质的量是1molD0.1mol/L的Ba(OH)2溶液中,OH的个数为0.2NA个6关于下列各实验装置的叙述中,不正确的是 A装置可用于分离酒精和水的混合物B装置可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体C装置中若装满水,收集H2的时候应该从a口通入H2D装置用CCl4萃取碘水中的碘时,CCl4层在下层7丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1g/mL,沸点约55,分离水和丙酮时最合理的方法是( )A蒸发B分液C过滤D蒸馏8下列说法正确的是(NA表示阿伏加德罗常数的值)( )28g氮气所含有的原子数目为NA在常温常压下,11.2L N2含有的分子数为0.5NA在标况下 1mol Ne含有的原子数为NA标准状况下,1L水所含分子数为.4NA17g氨气所含电子数目为10NAABCD9粗盐中含Ca2+、Mg2+、Fe3+、SO42及泥沙等杂质,需要提纯后才能综合利用粗盐提纯的步骤有:加入过量的Na2CO3溶液;加入过量的BaCl2溶液;加入过量的NaOH溶液;加盐酸调节溶液的pH;溶解;过滤; 蒸发正确的操作顺序是( )ABCD10将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下下列说法错误的是( )物 质abcd反应前质量/g6.403.204.000.50反应后质量/g待测2.567.200.50Aa和b是反应物,d可能是催化剂B反应后a物质的质量为4.64gCc物质中元素的种类,一定和a、b二种物质中元素的种类相同D若物质a与物质b的相对分子质量之比为21,则反应中a与b的化学计量数(系数)之比为2l11下列说法正确的是( )A把100mL3molL1的H2SO4跟100mLH2O混合后硫酸的物质的量浓度为1.5molL1B把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是10%C把200mL3molL1的BaCl2溶液跟100mL3molL1的KCl溶液混合后,溶液中的c(Cl)仍然是3molL1D把100mL20%的NaOH溶液跟100mLH2O混合后,NaOH溶液的质量分数是10%12.要除去下列各组物质中的少量杂质,所选试剂和方法不可行的是选项物质杂质试剂、方法AO2水蒸气通过浓H2SO4洗气BMnO2炭粉在空气中灼烧CKCl溶液BaCl2加入适量的Na2SO4溶液,过滤DFeSO4溶液CuSO4加入足量铁屑,充分反应后过滤13.有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:溶液甲+乙乙+丙丙+丁甲+丁现象无明显现象白色沉淀白色沉淀无色气体根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是AHCl、BaCl2、H2SO4、Na2CO3 BH2SO4、HCl、BaCl2、Na2CO3CHCl、H2SO4、BaCl2、Na2CO3 DH2SO4、Na2CO3、HCl、BaCl214某同学用托盘天平称量锌粒24.4g(1g以下用游码),他把锌粒放在右盘,砝码放在左盘,当天平平衡时,所称取的锌粒的实际质量应是()A24.4gB25.5gC23.6gD24g15实验室进行NaCl溶液蒸发时,一般有以下操作过程:放置酒精灯固定铁圈的位置放上蒸发皿加热搅拌停止加热、余热蒸干其正确的操作顺序是()ABC D16下列实验操作中叙述正确的是()A萃取操作必须在分液漏斗中进行B振荡试管中液体时,手拿住试管,用手腕甩动C用剩的药品应收集起来放回原试剂瓶中D称量物质时先取小砝码,再依次取较大的砝码17下列叙述正确的是()A1 mol O2的质量为32g/mol B摩尔是国际单位制中的一个基本物理量C3.011023个CO2分子的质量为22g DH2O的摩尔质量为18g18下列实验能达到预期目的是()A用酒精萃取碘水中的碘B将气体通过灼热CuO以除去O2中混有的H2C用分液法分离花生油和水D海盐经过溶解、过滤、蒸发制纯净的NaCl19以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )CCO2H2CO3CaCO3CO2A化合 置换 分解 复分解B置换 复分解 化合 分解C置换 化合 复分解 分解D置换 化合 分解 复分解20同温同压下,16.5g气体X的体积与12gO2的体积相同,则X为( )ACOBCH4CCO2DSO221在VL硫酸铝溶液中,含有WgAl3+离子,这种溶液中SO42的物质的量浓度是()A mol/L B mol/L C mol/L D mol/L22在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl各为1.5mol,Mg2+为0.5mol,则SO42的物质的量为( )A0.1molB0.5molC0.15molD0.25mol23重金属是指相对原子质量大于55的金
可能用到的数据和资料:相对原子质量:H~1 C~12 O~16Fe~56
1.空气中含量较多且化学性质不活泼的气体是
A.氮气 B.氧气 C.稀有气体 D.二氧化碳
此题为判断题(对,错)。
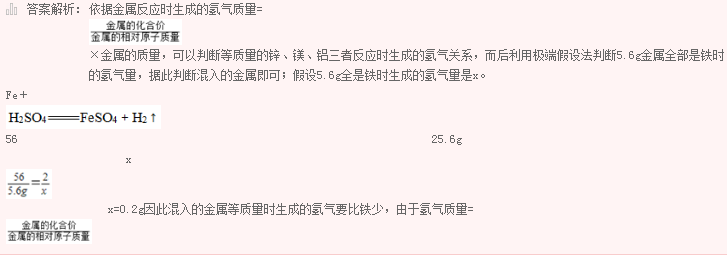
现有4g由Cu和另一种金属形成的混合物,将其加入足量的稀盐酸充分反应后得到0.2g氢气,则另一种金属是( )。
选项 A B C D Ag Zn Fe Mg 金属活动性顺序 强 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 弱
B.Zn
C.Mg
D.Ag
B.Fe2+、H+、so32-、Cl0-
C.Mg2+,NH4+、Cl一、S042-
D.K+、Fe3+、N03-;、SCN-
相关考题:
- 沉没成本
- 多选题中国标准化工作者在长期标准化工作实践中概括的标准化原理包括()。A简化原理B统一原理C优化原理D协调原理
- 主诉检察官制度
- 为什么说法院属于国家机关?
- 如果工资率为每小时25元,劳动力的边际产量收入为每小时40元,理性的生产者就会()A、在生产中增加使用劳动力B、在生产中减少使用劳动力C、在生产中劳动力投入量不变D、提高工资率
- 主侦检察官
- 普通铸铁坩埚寿命较短,正常熔炼条件下使用炉次为()炉。球墨铸铁坩埚能熔炼()炉次。
- 单选题包装标准化工作的内容,一般包括制定包装标准、()、包装容器标准化及制定包装工艺标准。A制定包装件试验方法;B严格执行包装标志;C制定包装件运输要求;D制定包装件的储存要求。
- 法院横向组织体系是怎样分类的?
- 玻璃液的分隔装置什么作用?主要有哪几种?
- 河北省保定市安新县2021-2022学年七年级下学期期末考试道德与法治试题(文字版含答案)-
- 小学教职工扫黑除恶测试题-
- 陕西省渭南市富平县2021-2022学年七年级下学期期末考试道德与法治试题(文字版含答案)-
- 2019年学法考试之扫黑除恶练习题与答案-
- 山东省济宁市嘉祥县2021-2022学年七年级下学期期末道德与法治试题(文字版含答案)-
- 2022年山东省威海市中考语文真题(文字解析版)-
- 2022年四川省广元市中考语文试卷(文字版含答案解析)-
- 2021-2022山东省济宁市金乡县七年级下册道德与法治期末测试卷(文字版含答案)-
- 2022年四川省宜宾市中考语文试题(文字版含答案)-
- 河北省邢台市威县第三中学 2021-2022学年七年级下学期期末考试道德与法治试卷(文字版版含答案)-