20182022年高考化学试题汇编( 水溶液中的离子平衡)
(1) X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为__________________________
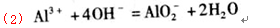
【解析】

A、NaOH
B、Na2CO3
C、Ca(OH)2
D、NaClO
下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HclO+HCO-3
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++C
C.向NaAlO2溶液中通入过量CO2制Al(OH)3
↓HCO-3
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4;
(3)B中溶液发生反应的离子方程式是________ 。
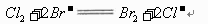
电解质溶液中的离子水化现象是
A、离子周围被水偶极子所包围
B、离子溶解于水溶液中
C、离子在溶液中与水的结合
D、电解质在水中保持离子状态
E、电解质溶液中离子与水化合
专题 水溶液中的离子平衡【2022年】1(2022海南卷)NaClO溶液具有添白能力,已知25时,。下列关于NaClO溶液说法正确的是A0.01mol/L溶液中,B长期露置在空气中,释放,漂白能力减弱C通入过量,反应的离子方程式为D25,的NaClO和HClO的混合溶液中,2(2022浙江卷)时,苯酚的,下列说法正确的是A相同温度下,等的和溶液中,B将浓度均为的和溶液加热,两种溶液的均变大C时,溶液与溶液混合,测得,则此时溶液中D时,的溶液中加少量固体,水的电离程度变小3(2022浙江卷)时,向浓度均为的盐酸和醋酸的混合溶液中逐滴加入的溶液(酷酸的;用的溶液滴定等浓度的盐酸,滴定终点的突跃范围4.39.7)。下列说法不正确的是A恰好中和时,溶液呈碱性B滴加溶液至的过程中,发生反应的离子方程式为:C滴定过程中,D时,4(2022全国乙卷)常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。设溶液中,当达到平衡时,下列叙述正确的是A溶液中B溶液中的HA的电离度为C溶液和中的不相等D溶液和中的之比为5(2022湖南卷)室温时,用的标准溶液滴定浓度相等的、和混合溶液,通过电位滴定法获得与的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于时,认为该离子沉淀完全。,)。下列说法正确的是Aa点:有白色沉淀生成B原溶液中的浓度为C当沉淀完全时,已经有部分沉淀Db点:6(2022山东卷)工业上以为原料生产,对其工艺条件进行研究。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是A反应的平衡常数BC曲线代表含的溶液的变化曲线D对含且和初始浓度均为的混合溶液,时才发生沉淀转化7(2022海南卷)某元素M的氢氧化物在水中的溶解反应为:、,25,-lgc与pH的关系如图所示,c为或浓度的值,下列说法错误的是A曲线代表与pH的关系B的约为C向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在D向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在【2021年】1(2021全国乙)HA是一元弱酸,难溶盐MA的饱和溶液中随c(H+)而变化,不发生水解。实验发现,时为线性关系,如下图中实线所示。下列叙述错误的是A溶液时,BMA的溶度积度积C溶液时,DHA的电离常数2(2021浙江)取两份 的溶液,一份滴加的盐酸,另一份滴加溶液,溶液的pH随加入酸(或碱)体积的变化如图。下列说法不正确的是A由a点可知:溶液中的水解程度大于电离程度B过程中:逐渐减小C过程中:D令c点的,e点的,则3(2021浙江)某同学拟用计测定溶液以探究某酸HR是否为弱电解质。下列说法正确的是A25时,若测得溶液,则HR是弱酸B25时,若测得溶液且,则HR是弱酸C25时,若测得HR溶液,取该溶液,加蒸馏水稀释至,测得,则HR是弱酸D25时,若测得NaR溶液,取该溶液,升温至50,测得,则HR是弱酸4(2021湖南)常温下,用的盐酸分别滴定20.00mL浓度均为三种一元弱酸的钠盐溶液,滴定曲线如图所示。下列判断错误的是A该溶液中:B三种一元弱酸的电离常数:C当时,三种溶液中:D分别滴加20.00mL盐酸后,再将三种溶液混合:5(2021山东)赖氨酸H3N+(CH2)4CH(NH2)COO-,用HR表示是人体必需氨基酸,其盐酸盐(H3RCl2)在水溶液中存在如下平衡:H3R2+H2R+HRR-。向一定浓度的H3RCl2溶液中滴加NaOH溶液,溶液中H3R2+、H2R+、HR和R-的分布系数(x)随pH变化如图所示。已知(x)=,下列表述正确的是ABM点,c(Cl-) +c(OH-)+c(R-)=2c(H2R+)+c(Na+)+c(H+)CO点,pH=DP点,c(Na+)c(Cl-)c(OH-)c(H+)【2020年】1.(2020浙江卷)下列物质在熔融状态下不导电的是( )A. NaOHB. CaCl2C. HClD. K2SO42.(2020浙江卷)下列说法不正确的是( )A. 的盐酸中B. 将KCl溶液从常温加热至80,溶液的pH变小但仍保持中性C. 常温下,NaCN溶液呈碱性,说明HCN是弱电解质D. 常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大3.(2020新课标)以酚酞为指示剂,用0.1000 molL1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积VNaOH的变化关系如图所示。比如A2的分布系数:下列叙述正确的是A. 曲线代表,曲线代表B. H2A溶液的浓度为0.2000 molL1C. HA的电离常数Ka=1.0102D. 滴定终点时,溶液中4.(2020江苏卷)室温下,将两种浓度均为的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是A. 混合溶液(pH=10.30):B. 氨水-NH4Cl混合溶液(pH=9.25):C. 混合溶液(pH=4.76): D. 混合溶液(pH=1.68,H2C2O4为二元弱酸): 5.(2020山东卷)25时,某混合溶液中,1gc( CH3COOH)、1gc(CH3COO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是A. O点时,B. N点时,C. 该体系中,D. pH由7到14的变化过程中, CH3COO-的水解程度始终增大6.(2020天津卷)常温下,下列有关电解质溶液的说法错误的是A. 相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则 B. 相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中C. FeS溶于稀硫酸,而CuS不溶于稀硫酸,则D. 在溶液中,7.(2020浙江卷)常温下,用氨水滴定浓度均为的和的混合液,下列说法不正确的是( )A. 在氨水滴定前,和的混合液中B. 当滴入氨水时,C. 当滴入氨水时,D. 当溶液呈中性时,氨水滴入量大于,8.(2020江苏卷)吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-、SO32-的物质的量分数随pH的分布如图-1所示。(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为_;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是_(填化学式)。(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40mim内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图-2)。溶液pH几乎不变阶段,主要产物是_(填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为_。(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.56.5范围内,pH越低SO生成速率越大,其主要原因是_;随着氧化的进行,溶液的pH将_(填“增大”、“减小”或“不变”)。【2019年】12019新课标NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1103 ,Ka2=3.9106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是A混合溶液的导电能力与离子浓度和种类有关 BNa+与A2的导电能力之和大于HA的 Cb点的混合溶液pH=7 Dc点的混合溶液中,c(Na+)c(K+)c(OH)22019新课标绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 A图中a和b分别为T1、T2温度下CdS在水中的溶解度B图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)Ksp(p)c(OH)B随温度升高,CH3COONa溶液的c(OH)减小C随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果D随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同52019天津某温度下,和的电离常数分别为和。将和体积均相同的两种酸溶液分别稀释,其随加水体积的变化如图所示。下列叙述正确的是A曲线代表溶液B溶液中水的电离程度:b点c点C从c点到d点,溶液中保持不变(其中、分别代表相应的酸和酸根离子)D相同体积a点的两溶液分别与恰好中和后,溶液中相同62019江苏室温下,反应+H2OH2CO3+OH的平衡常数K=2.2108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是A0.2 molL1氨水:c (NH3H2O)c() c (OH) c (H+)B0.2 molL1NH4HCO3溶液(pH7):c () c () c (H2CO3) c (NH3H2O)C0.2 molL1氨水和0.2 molL1NH4HCO3溶液等体积混合:c()+c(NH3H2O)=c(H2CO3)+c ()+c()D0.6 molL1氨水和0.2 molL1 NH4HCO3溶液等体积混合:c (NH3H2O)+ c()+ c(OH)=0.3 molL1+ c (H2CO3)+ c (H+)72019浙江选考室温下,取20 mL 0.1 molL1某二元酸H2A,滴加0.1 molL1 NaOH溶液。已知:H2AH+HA,HAH+A2。下列说法不正确的
A.NaClO溶液
B.浓盐酸
C.KMnO4溶液
D.Br2/CCl4溶液
A.能与碱作用生成水
B.其水溶液能使石蕊试纸变红
C.其水溶液有氢离子和酸根离子
D.在水溶液中电离产生的阳离子只有H+
A. NaCl B. Na2CrO4 C. NaCrO2 D. NaClO
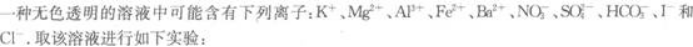
(1)将溶液滴在pH试纸上,试纸显红色.
(2)将少许溶液浓缩后加入铜片和硫酸,有无色气体析出.此气体遇空气则立即变为红棕色.
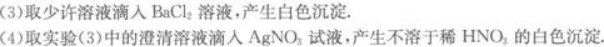
(5)另取少许溶液滴入NaOH溶液,有白色沉淀生成.当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断,原溶液中肯定不存在的离子是____________;肯定存在的离子是____________;不能作出判断的离子是____________.写出各步反应的离子方程式____________________________________。
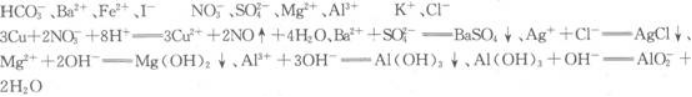
相关考题:
- 关于非上市公众公司收购中的收购人变更收购要约,下列说法正确的有()。 Ⅰ收购人需要变更收购要约的,应当重新编制并披露要约收购报告书 Ⅱ重新编制并披露要约收购报告书应报送全国股份转让系统,同时通知被收购公司 Ⅲ变更后的要约收购价格不得高于变更前的要约收购价格 Ⅳ收购要约期限届满前15日内,收购人在任何情况下不得变更收购要约 Ⅴ出现竞争要约时,发出初始要约的收购人变更收购要约距初始要约收购期限届满不足15日的,应当延长收购期限,延长后的要约期应当不少于15日A、Ⅰ、ⅡB、Ⅰ、Ⅱ、ⅤC、Ⅰ、Ⅲ、ⅣD、Ⅲ、Ⅳ、ⅤE、Ⅱ、Ⅲ、Ⅳ、Ⅴ
- 什么农药安全间隔期?
- 智护®多功能护理液的杀菌成分是:()A、EDTA+硼酸B、EDTA+氯化钠C、EDTA+PQ1D、Alexidine+PQ1
- 什么是农产品标准化生产?
- 什么是浙江绿色农产品?
- 如何申请浙江农产品?
- 防紫外线隐形眼镜的独特之处不包括?()A、可阻挡由框架边缘透入的紫外线B、包覆整体瞳孔有效的防止紫外线透入眼底C、一年四季随时随地都帮您保护眼睛D、摩擦系数低,镜片柔软,配戴舒适度高
- 隐形眼镜的优势不包括()。A、视野更开阔B、不压迫鼻梁C、戴镜前要经过练习D、更自然的外观
- 对急危重病进行现场快速评估判断以下哪项不对()A、对婴儿轻拍面颊观察其有否出现哭泣等反应来判断意识B、通过一看、二听、三感觉方法来判断判断病人自主呼吸是否存在C、触摸桡动脉脉搏了解病人脉率及脉律及动脉搏动是否存在D、如神志清肢体不能活动要警惕脊髓损伤,注意制动保护
- 农产品质量安全检测机构出具检测结果不实,造成损害的,依法承担赔偿责任;造成重大损害的,并撤销其检测资格