金属单质X,常温下液态单质Y和气态单质X,以及化合物A、B、C有如图2—1所示的反应关系:(1)写出化学式:X____________,Y____________,Z____________.(2)写出G→A的离子方程式:____________________________________.(3)A的水溶液呈酸性,其溶于水会使水的电离平衡发生移动,离子方程式为____________________________________。
金属单质X,常温下液态单质Y和气态单质X,以及化合物A、B、C有如图2—1所示的反应关系:
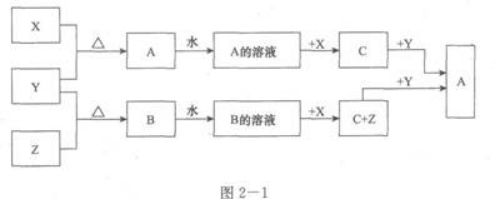
(1)写出化学式:X____________,Y____________,Z____________.
(2)写出G→A的离子方程式:____________________________________.
(3)A的水溶液呈酸性,其溶于水会使水的电离平衡发生移动,离子方程式为____________________________________。

(1)写出化学式:X____________,Y____________,Z____________.
(2)写出G→A的离子方程式:____________________________________.
(3)A的水溶液呈酸性,其溶于水会使水的电离平衡发生移动,离子方程式为____________________________________。
参考解析
解析: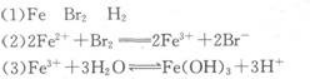
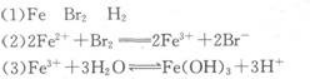
相关考题:
(1) 一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。① Z与H2O2反应,其产物之一是Y的单质,Y的单质地电子式为____________;Z分子的结构呈_______________② A的化学式是 _____________________
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是______________________
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是A.X、M两种元素只能形成X2M型化合物B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低C.元素Y、Z、W的单质晶体属于同种类型的晶体D.元素W和M的某些单质可作为水处理中的消毒剂
各选一种化学药品鉴别下列各组物质,并指出鉴别依据及反应的化学方程式.(1)BaS04和BaCO3:试剂为__________,依据为____________________,离子方程式为______________________________.(2)Al(OH)3和Mg(OH)2:试剂为__________,依据为____________________,离子方程式为______________________________.(3)NH4C1和(NH4)2S04:试剂为__________,依据为____________________,离子方程式为______________________________.(4)Na2C03和NaHC03:试剂为__________,依据为____________________,离子方程式为______________________________.
明矾水溶液呈酸性的离子方程式是____________________,出现浑浊时,消除的方法是____________________;纯碱与水作用的离子方程式是____________________,若要增强其洗涤力应____________________.
元素X、Y、Z都位于短周期,它们的原子序数按X、Y、Z的顺序依次增大。X和Z位于同一主族,Y和Z位于同一周期。Y的单质与2的单质相互作用,生成离子化合物Y2Z。则X原子的结构示意图为__________。Y2Z的电子式为__________。
颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”。⑴在高温条件下,用H2与FeCl2反应,可生成“纳米铁”和一种溶于水显强酸性的气体,写出该反应的化学方程式( ) 。⑵“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式( ) 。⑶请你预测“纳米铁”的其他化学性质,用化学反应方程式表示( ) 。
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z组成原电池时,Z为正极;Y和Z两种离子在同一溶液中被电解时.阴极只能得到Y单质:M离子的氧化性强于Y离子。则这四种金属的活动性由强到弱的顺序是:( )。A、X>Z>Y>MB、X>Y>Z>MC、M>Z>X>YD、X>Z>M>Y
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和2-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )。.A.原子的最外层电子数:X>Y>ZB.单质沸点:X>Y>ZC.离子半径:X>Y>z-D.原子序数:X>Y>Z
右图中的物质都是初中化学常见物质,其中A、B为单质,B是可供动植物呼吸的气体;甲、乙、丙为化合物,甲与过量的丙、乙与过量的丙两两反应的所有产物相同。图中“—”表示两端的物之间能发生化学反应;“→”表 示物质间存在转化关 系;部分反应物或生成物已略去。(1)写出B的化学式___________________;写出一种丙的名称___________________。(2)写出A和甲反应的化学方程式:___________________。(3)写出乙→甲的化学方程式:___________________。
通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答: (1)用化学符号表示下列4种微粒:A:()B:()C://()D://()。 (2)写出A、B、E三种微粒反应的离子方程式:()
X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中不正确的是( )A、Y的单质是金属晶体B、X的单质固态时为分子晶体C、X与碳形成的化合物为分子晶体D、X与Y形成的化合物固态时为分子晶体
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。
元素X和Y在元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是()A、X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质B、Y元素的单质不能和金属氧化物反应C、X和Y构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素阳离子D、X元素的一种单质能有效地吸收太阳光线中的紫外线
单选题元素X和Y在元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是()AX和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质BY元素的单质不能和金属氧化物反应CX和Y构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素阳离子DX元素的一种单质能有效地吸收太阳光线中的紫外线
填空题已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题: (1)若X、Y均为非金属元素,写出你所知道的XY2的化学式:()、()、()、()等。 (2)若X原子的外围电子层排布为3d104s2,Y可能是()元素或()元素(写元素符号)。 (3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:()、()、()、()、()、()、()。