已知: φ0=1.498V φθ=1.00V则反应的稳定常数为( )。
已知: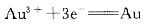 φ0=1.498V
φ0=1.498V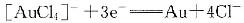 φθ=1.00V则反应
φθ=1.00V则反应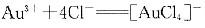 的稳定常数为( )。
的稳定常数为( )。
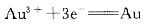 φ0=1.498V
φ0=1.498V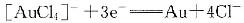 φθ=1.00V则反应
φθ=1.00V则反应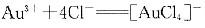 的稳定常数为( )。
的稳定常数为( )。
参考解析
解析:稳定常数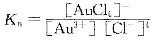 ,根据Nernst方程
,根据Nernst方程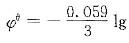 ,及
,及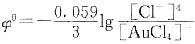 ,代入数值,可以算出
,代入数值,可以算出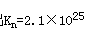
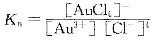 ,根据Nernst方程
,根据Nernst方程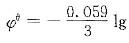 ,及
,及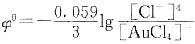 ,代入数值,可以算出
,代入数值,可以算出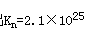
相关考题:
已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应AgCl(s)+2N3H = [Ag(NH3)2]++ Cl-的平衡常数K为()。A、KsKspB、1/KsKspC、Ks/KspD、Ksp/Ks
已知AgCl的溶度积常数为Ksp,[Ag(NH3)2]+的稳定常数为Ks,则反应AgCl(s)+2NH3=[Ag(NH3)2]++Cl-的平衡常数为()A、KsKspB、1/KsKspC、Ks/KspD、Ksp/Ks
已知φθAu3+/Au=1.498V,φθ[AuCl4]-Au=1.00V.则[AuCl4]-的稳定常熟是()A、3.74×10-18B、2.1×1025C、4.76×1026D、8.1×1020E、2.0×10-25
对Do Until..Loop循环,正确的是()。A、如果循环条件为常数0,则一次循环也不执行B、如果循环条件为常数0,则至少执行一次循环C、如果循环条件是不为0的常数,则至少执行一次循环D、无论循环条件是否为"True",则至少执行一次循环
单选题已知A=(3,5,-2),0B=(2,1,4),要使λA+μB与C=(0,0,1)垂直,则常数λ与μ应满足关系()。Aλ0=2μBλ=μCμ0=2λDλ=-μ