反应,此温度下平衡时, 如p(PCl5)=p(PCl3),则p(C12)等于:A. 130. 38kPaB. 0. 767kPaC. 7607kPaD. 7. 67X10-3kPa
反应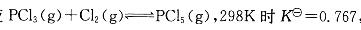 ,此温度下平衡时, 如p(PCl5)=p(PCl3),则p(C12)等于:
,此温度下平衡时, 如p(PCl5)=p(PCl3),则p(C12)等于:
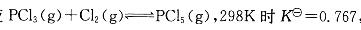 ,此温度下平衡时, 如p(PCl5)=p(PCl3),则p(C12)等于:
,此温度下平衡时, 如p(PCl5)=p(PCl3),则p(C12)等于:
A. 130. 38kPa
B. 0. 767kPa
C. 7607kPa
D. 7. 67X10-3kPa
B. 0. 767kPa
C. 7607kPa
D. 7. 67X10-3kPa
参考解析
解析: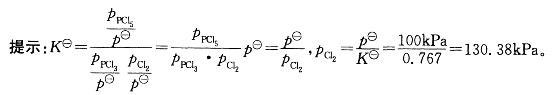
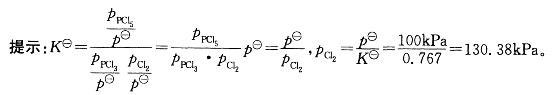
相关考题:
当事件A与B同时发生时,事件C必发生,则下列结论正确的是( )。A.P(C)=P(AB)B.P(C)=P(A并B)C.P(C)大于等于P(A)+P(B)-1D.P(C)小于等于P(A)+P(B)-1
经u检验,若u值等于2.95,则最接近的概率P应是A.P0.01C.P=0.01D.P>0.05E.P 经u检验,若u值等于2.95,则最接近的概率P应是A.P<0.01B.P>0.01C.P=0.01D.P>0.05E.P<0.05
经u检验,若u值等于2.95,则最接近的概率P应是A.P0.01C.P=0.01SXB 经u检验,若u值等于2.95,则最接近的概率P应是A.P<0.01B.P>0.01C.P=0.01D.P<0.05E.P>0.05
某温度下,在密闭容器中进行如下反应2A(g)+B(g)2C(g),开始时p(A)=p(B)=300kPa,p(C)=0kPa,平衡时,p(C)=100kPa,在此温度反应的标准平衡常数K是( )。 A. 0.1 B. 0.4 C. 0.001 D. 0.002
对于可逆反应:PCl5(g)===PCl3(g)+Cl2(g),下列说法正确的是:( )A.恒温下,增大压力,由于产物分子数多,Kc值减小,平衡逆向移动B.升高温度,反应速度加快,PCl5的分解率增大C.减小总压力,反应速度减慢,PCl5转化率降低D.降低温度,PCl5的分解率降低,此反应为吸热反应
设T=(t1,t2,„„,tn)为概率向量,P=(Pij)n*n为概率矩阵,则当k→∞时,必有()A、TPk等于P的平衡概率矩阵B、TPk不等于P的平衡概率矩阵C、TPk与P的平衡概率矩阵中的任一行向量都相等D、TPk与P的平衡概率矩阵中的任一行向量都不相等
PCl5(g) = PCl3(g) + Cl2(g),在一定T和P下,若一定量的PCl5气体的体积为1升,此时PCl5气体已有50%分解为PCl3和 Cl2。若减少压力使体积变为2升,则PCl5的分解率将(),若保持压力不变,加入氦气,使体积变为2,则PCl5的分解率将()。(填“增大”、“减少”、“不变”)
PCl5的分解反应:PCl5(g)=PCl3(g)+Cl2(g),2000C达到平衡时有48.5%分解,3000C达到平衡时有97%分解。则下列说法正确的是()A、此反应为放热反应B、反应是吸热反应C、升高温度,平衡逆向移动D、压力改变对平衡无影响
反应PCl3(g)+Cl2(g)PC5(g),在298K时,,此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)=()。A、130.38kPaB、0.767kPaC、7607kPaD、7.67×10-3kPa
设反应aA+bB=gG+hH,在p下,300K时的转化率是600K的2倍,在300K下,总压力为p时的转化率是总压力2p的2倍,可推测该反应:()A、平衡常数与温度、压力成正比B、平衡常数与温度成正比,与压力成反比C、该反应是一个体积增加的放热反应D、该反应是一个体积增加的吸热反应
当温度T时,将纯NH4HS(s)置于抽空的容器中,则NH4HS(s)发生分解:NH4HS(s)=NH3(g)+H2S(g)测得平衡时物系的总压力为p,则平衡常数Kp为()A、p2/4B、p/4C、p2D、p2/2
在一定的T,P下,A(g)=B(g)+C(g)达平衡时A的解离度为α1。T,P不变,向系统加入惰性气,平衡时转化率为α2,则α2()α1,若反应为洗热反应,压力不变升温,平衡转化率为α3,则α3()α1
单选题反应PCl3(g)+Cl2(g)PC5(g),在298K时,,此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)=()。A130.38kPaB0.767kPaC7607kPaD7.67×10-3kPa
单选题当事件A与B同时发生时,事件C必发生,则下列结论正确的是( )。AP(C)=P(AB)BP(C)=P(A∪B)CP(C)大于等于P(A)+P(B)-1DP(C)小于等于P(A)+P(B)-1
单选题完全不互溶的二元物系,沸点温度()A等于P01B等于P02C等于P01+P02D小于P01+P02