给出下列基态原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子则用箭头表示。
给出下列基态原子或离子的价电子层电子组态,并用方框图表示轨道,填入轨道的电子则用箭头表示。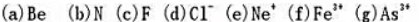
相关考题:
16、关于电子组态,下列哪个选项是错误的: A. 原子的电子组态能反映出该原子中所有电子占据的亚层轨道。 B. 电子总是优先占据可供占据的能量最低的轨道,占满能量较低的轨道后才进入能量较高的轨道。 C. 同一原子中不能存在运动状态完全相同的电子。 D. 电子分布到等价轨道时,总是尽先以相同的自旋状态占据满同一轨道。A.AB.BC.CD.D
Fe元素基态有四个价电子分占不同的d轨道,但是Ca元素基态的两个价电子却占据同一轨道。下列说法错误的是A.Fe的基态组态有四个电子分占不同的d轨道,是因为这种电子组态排斥能小B.Ca的基态组态两个价电子占据同一轨道,是因为这种电子组态排斥能小C.Fe的基态组态有四个电子分占不同的d轨道,符合Pauli原理和Hund规则D.Ca的基态组态中其它未占据轨道能量很高,两个价电子占据同一轨道使得电子组态能量较低
关于原子轨道的下列叙述正确的是A.原子轨道不同于宏观物体的轨道。B.某一原子轨道是电子的一种空间运动状态,即波函数C.原子轨道表示电子在空间各点出现的概率D.原子轨道表示电子在空间各点出现的概率密度