高中化学《核外电子的排布规律》一、考题回顾二、考题解析【教学过程】(一)提问导入【提出问题】原子的结构是怎样的?【学生回答】原子是由原子核和核外电子构成的。【提出问题】展示短周期元素原子的核电荷数及其核外电子数,让学生观察其规律。【学生回答】原子的核电荷数发生变化,核外电子的数目也在变化。【教师引导】核外电子排布有何规律,本节课来进行探究。(二)新课教学【多媒体展现】原子的剖面示意图,提出问题:能看出原子的排列有何规律?【学生回答】原子是分层排列的。【提出问题】如何表示电子的这种分层排布。【学生回答】在含有多个电子的原子里,电子分别在能量不同的区域内运动。把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5,6,7或K,L,M,N,O,P,Q来表示从内到外的电子层。【提出问题】电子在各层能量高低顺序是什么?与离核远近有什么联系?【讨论交流】电子能量:K【提出问题】核外电子既然是分层排布的,在排布时,电子是如何进入各电子层的呢?【学生回答】电子总是尽可能地先从能量低的内层排起,当一层充满后,再排下一层,即是按照从能量低的电子层到能量高的电子层依次排列的。【提出问题】结合前面已学过的碱金属元素,卤族元素的原子结构示意图,找出核外电子在每一层的排布有什么规律?【学生回答】K层不超过2个,M层不超过8个,M层作为次外层电子数目也不超过8。【教师总结】最外层电子数都不超过8个(K层不超过2个),次外层电子数不超过18个,倒数第三层电子数不超过32个。【提出问题】每一电子层最多填充的电子数有什么规律?【学生回答】每一电子层最多填充的电子数为2n2(n代表电子层数)个。(三)拓展提高画出卤族元素——碘元素的原子结构示意图。(四)小结作业小结:学生总结本节课的内容。作业:元素的原子核外电子排布呈现周期性的变化,推断元素的性质有什么变化?【板书设计】【答辩题目解析】1.电子层的排布规律比较抽象,你是如何让学生理解这一知识的?2.本课是微观内容,学生不容易理解,本节课你是如何解决这一问题的?
高中化学《核外电子的排布规律》
一、考题回顾
二、考题解析
【教学过程】
(一)提问导入
【提出问题】原子的结构是怎样的?
【学生回答】原子是由原子核和核外电子构成的。
【提出问题】展示短周期元素原子的核电荷数及其核外电子数,让学生观察其规律。
【学生回答】原子的核电荷数发生变化,核外电子的数目也在变化。
【教师引导】核外电子排布有何规律,本节课来进行探究。
(二)新课教学
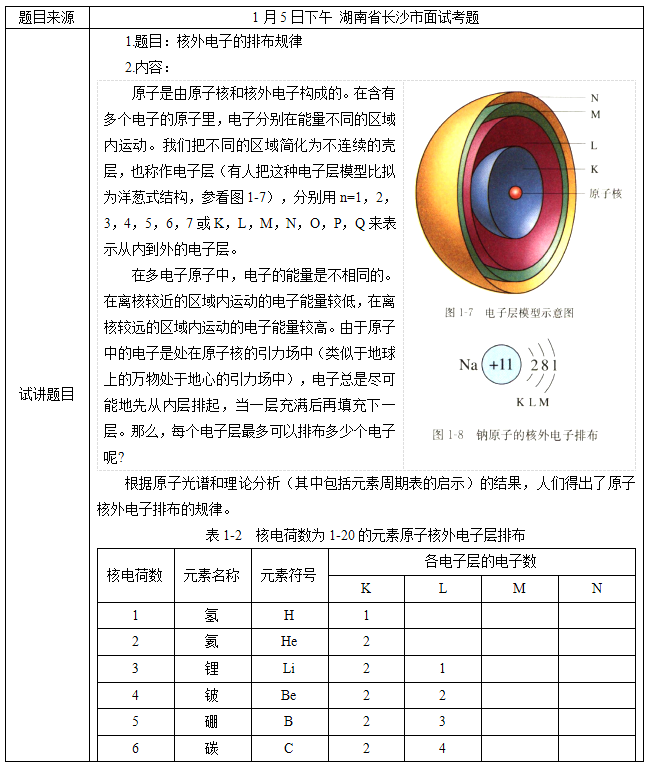
【多媒体展现】原子的剖面示意图,提出问题:能看出原子的排列有何规律?
【学生回答】原子是分层排列的。
【提出问题】如何表示电子的这种分层排布。
【学生回答】在含有多个电子的原子里,电子分别在能量不同的区域内运动。把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5,6,7或K,L,M,N,O,P,Q来表示从内到外的电子层。
【提出问题】电子在各层能量高低顺序是什么?与离核远近有什么联系?
【讨论交流】电子能量:K
【提出问题】核外电子既然是分层排布的,在排布时,电子是如何进入各电子层的呢?
【学生回答】电子总是尽可能地先从能量低的内层排起,当一层充满后,再排下一层,即是按照从能量低的电子层到能量高的电子层依次排列的。
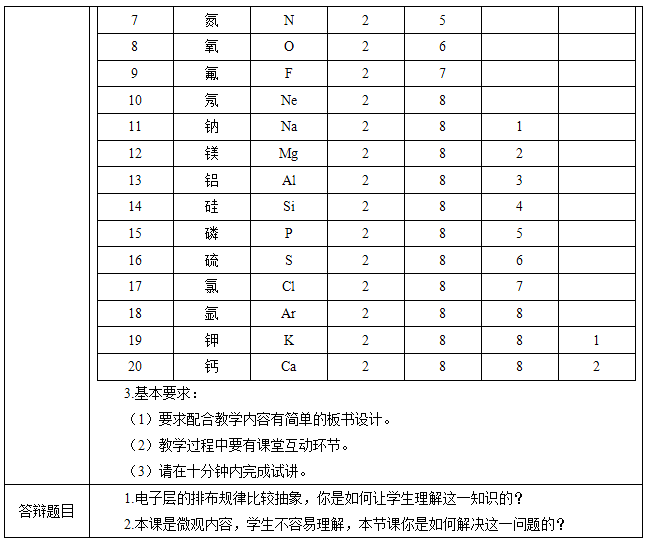
【提出问题】结合前面已学过的碱金属元素,卤族元素的原子结构示意图,找出核外电子在每一层的排布有什么规律?
【学生回答】K层不超过2个,M层不超过8个,M层作为次外层电子数目也不超过8。
【教师总结】最外层电子数都不超过8个(K层不超过2个),次外层电子数不超过18个,倒数第三层电子数不超过32个。
【提出问题】每一电子层最多填充的电子数有什么规律?
【学生回答】每一电子层最多填充的电子数为2n2(n代表电子层数)个。
(三)拓展提高
画出卤族元素——碘元素的原子结构示意图。
(四)小结作业
小结:学生总结本节课的内容。
作业:元素的原子核外电子排布呈现周期性的变化,推断元素的性质有什么变化?
【板书设计】

【答辩题目解析】
1.电子层的排布规律比较抽象,你是如何让学生理解这一知识的?
2.本课是微观内容,学生不容易理解,本节课你是如何解决这一问题的?
一、考题回顾


二、考题解析
【教学过程】
(一)提问导入
【提出问题】原子的结构是怎样的?
【学生回答】原子是由原子核和核外电子构成的。
【提出问题】展示短周期元素原子的核电荷数及其核外电子数,让学生观察其规律。
【学生回答】原子的核电荷数发生变化,核外电子的数目也在变化。
【教师引导】核外电子排布有何规律,本节课来进行探究。
(二)新课教学
【多媒体展现】原子的剖面示意图,提出问题:能看出原子的排列有何规律?
【学生回答】原子是分层排列的。
【提出问题】如何表示电子的这种分层排布。
【学生回答】在含有多个电子的原子里,电子分别在能量不同的区域内运动。把不同的区域简化为不连续的壳层,也称作电子层,分别用n=1,2,3,4,5,6,7或K,L,M,N,O,P,Q来表示从内到外的电子层。
【提出问题】电子在各层能量高低顺序是什么?与离核远近有什么联系?
【讨论交流】电子能量:K
【提出问题】核外电子既然是分层排布的,在排布时,电子是如何进入各电子层的呢?
【学生回答】电子总是尽可能地先从能量低的内层排起,当一层充满后,再排下一层,即是按照从能量低的电子层到能量高的电子层依次排列的。
【提出问题】结合前面已学过的碱金属元素,卤族元素的原子结构示意图,找出核外电子在每一层的排布有什么规律?
【学生回答】K层不超过2个,M层不超过8个,M层作为次外层电子数目也不超过8。
【教师总结】最外层电子数都不超过8个(K层不超过2个),次外层电子数不超过18个,倒数第三层电子数不超过32个。
【提出问题】每一电子层最多填充的电子数有什么规律?
【学生回答】每一电子层最多填充的电子数为2n2(n代表电子层数)个。
(三)拓展提高
画出卤族元素——碘元素的原子结构示意图。
(四)小结作业
小结:学生总结本节课的内容。
作业:元素的原子核外电子排布呈现周期性的变化,推断元素的性质有什么变化?
【板书设计】

【答辩题目解析】
1.电子层的排布规律比较抽象,你是如何让学生理解这一知识的?
2.本课是微观内容,学生不容易理解,本节课你是如何解决这一问题的?
参考解析
解析:1.
首先结合课本上的模型图片和讲解给学生,按照离核的远近,电子层的能量不同,所能容纳的电子数也不同,其次继续讲解他的排布规律最多是2n2,让学生自己计算这个规律,最后结合动画图的形式,直观的播放给学生,让学生从直观到抽象,逐步的接受这节课的知识。
2.
本节课是学生走进微观世界的第一课,理解较有难度,在导入部分通过知识的前后联系提出悬疑式问题来引起学生的好奇心和求知欲,激发起他们的探究欲望,对于核外电子排布规律的知识可使用多媒体动画的方式进行直观呈现,帮助学生更好的理解原子中的电子排布,同时对于较复杂的问题可以组织学生展开小组讨论得出对应的结论。
首先结合课本上的模型图片和讲解给学生,按照离核的远近,电子层的能量不同,所能容纳的电子数也不同,其次继续讲解他的排布规律最多是2n2,让学生自己计算这个规律,最后结合动画图的形式,直观的播放给学生,让学生从直观到抽象,逐步的接受这节课的知识。
2.
本节课是学生走进微观世界的第一课,理解较有难度,在导入部分通过知识的前后联系提出悬疑式问题来引起学生的好奇心和求知欲,激发起他们的探究欲望,对于核外电子排布规律的知识可使用多媒体动画的方式进行直观呈现,帮助学生更好的理解原子中的电子排布,同时对于较复杂的问题可以组织学生展开小组讨论得出对应的结论。
相关考题:
关于电子的排布规律,下列说法正确的是()A、在同一个原子中,不可能有运动状态完全相同的两个电子同在B、核外电子总是尽先占能量最高的轨道C、在同一电子亚层的各个轨道上,电子的排布将尽可能分占不同的轨道,而且自旋方向相同D、核外电子总是尽先占能量最低的轨道
单选题按核外电子排布规律,预测核电荷数为112的元素,核外各电子层排布的电子数依次是( )A2,8,18,32,52B2,8,18,32,50,2C2,8,18,32,50,18,2D2,8,18,32,32,18,2
单选题关于电子的排布规律,下列说法正确的是()A在同一个原子中,不可能有运动状态完全相同的两个电子同在B核外电子总是尽先占能量最高的轨道C在同一电子亚层的各个轨道上,电子的排布将尽可能分占不同的轨道,而且自旋方向相同D核外电子总是尽先占能量最低的轨道