对于可逆反应:PCl(g)PCl(g)+Cl(g),下列说法正确的是A.升高温度,反应速度加快,PCl的分解率增大B.恒温下,增大压力,由于产物分子数多,K值减小,平衡逆向移动C.减小总压力,反应速度减慢,PCl转化率降低D.降低温度,PCl的分解率降低,此反应为吸热反应
对于可逆反应:PCl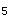 (g)
(g) PCl
PCl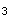 (g)+Cl
(g)+Cl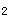 (g),下列说法正确的是
(g),下列说法正确的是
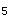 (g)
(g) PCl
PCl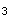 (g)+Cl
(g)+Cl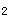 (g),下列说法正确的是
(g),下列说法正确的是A.升高温度,反应速度加快,PCl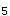 的分解率增大
的分解率增大
B.恒温下,增大压力,由于产物分子数多,K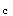 值减小,平衡逆向移动
值减小,平衡逆向移动
C.减小总压力,反应速度减慢,PCl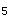 转化率降低
转化率降低
D.降低温度,PCl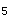 的分解率降低,此反应为吸热反应
的分解率降低,此反应为吸热反应
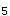 的分解率增大
的分解率增大
B.恒温下,增大压力,由于产物分子数多,K
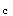 值减小,平衡逆向移动
值减小,平衡逆向移动
C.减小总压力,反应速度减慢,PCl
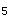 转化率降低
转化率降低
D.降低温度,PCl
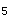 的分解率降低,此反应为吸热反应
的分解率降低,此反应为吸热反应参考解析
解析:
相关考题:
对于可逆反应:PCl(g)PCl(g)+Cl(g),下列说法正确的是() A.恒温下,增大压力,由于产物分子数多,K值减小,平衡逆向移动B.升高温度,反应速度加快,PCl的分解率增大C.减小总压力,反应速度减慢,PCl转化率降低D.降低温度,PCl的分解率降低,此反应为吸热反应
在某温度下,一密闭的刚性容器中的PCl5(g)达到分解平衡,若往此容器中充入N2(g)使体系压力增大二倍(此时体系仍可按理想气体处理),则PCl5(g)的离解度将A、增大B、减小C、不变D、视温度而定
药物氯化物检查,适宜的比浊浓度范围是A、(50~80μg) Cl/50 mlB、(10~50μg) Cl/50 mlC、(0.5~0.8μg) Cl/50 mlD、(0.1~0.5μg)Cl/50 mlE、(5~8μg) Cl/50 ml
对于可逆反应:PCl5(g)===PCl3(g)+Cl2(g),下列说法正确的是:( )A.恒温下,增大压力,由于产物分子数多,Kc值减小,平衡逆向移动B.升高温度,反应速度加快,PCl5的分解率增大C.减小总压力,反应速度减慢,PCl5转化率降低D.降低温度,PCl5的分解率降低,此反应为吸热反应
可逆反应Cl2(g)+3F2(g)↔2ClF3(g)的ΔrHmΘ(298K)=-326.4kJ·mol-1,为提高F2(g)的转化率,应采用()压()温的反应条件;当定温定容、系统组成一定时,加入He(g),α(F2)将()。
在273℃时,向真空容器中引人五氯化磷,此时容器中压力为1atm 测得气体的密度为2.48g/L,试从这些数据计算PCl5(g)←→PCl3(g)+ Cl2(g)的Kp和Kc及各平衡物质的分压。
PCl5(g) = PCl3(g) + Cl2(g),在一定T和P下,若一定量的PCl5气体的体积为1升,此时PCl5气体已有50%分解为PCl3和 Cl2。若减少压力使体积变为2升,则PCl5的分解率将(),若保持压力不变,加入氦气,使体积变为2,则PCl5的分解率将()。(填“增大”、“减少”、“不变”)
PCl5的分解反应:PCl5(g)=PCl3(g)+Cl2(g),2000C达到平衡时有48.5%分解,3000C达到平衡时有97%分解。则下列说法正确的是()A、此反应为放热反应B、反应是吸热反应C、升高温度,平衡逆向移动D、压力改变对平衡无影响
可逆反应2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔHθm〉0 ,反应达到平衡后,进行以下操作,试讨论其影响: (1)、增大容器体积,n(H2O,g)(); (2)、加入O2,n(HO,g)();n(HCl,g)(); (3)、减小容器体积,n(Cl2,g)();P(Cl2,g)();Kθ=(); (4)、加入稀有气体,保持体积不变,n(HCl,g)();保持压力不变,n(HCl,g)(); (5)、加入催化剂,n(HCl,g)()。
在一定温度和压强下,某一定量的PCl5气体体积为1L,此时PCl5已经有50%离解为PCl3和Cl2,试判断在下列情况下,PCl5的离解度是增加还是减少? (1)减少压强,使PCl5的体积变为2L; (2)保持压强不变,加入氮气,使体积增加至2L; (3)保持体积不变,加入氮气,使压强增加1倍; (4)保持压强不变,加入氯气,使体积变为2L; (5)保持体积不变,加入氯气,使压强增加1倍。
反应PCl3(g)+Cl2(g)PC5(g),在298K时,,此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)=()。A、130.38kPaB、0.767kPaC、7607kPaD、7.67×10-3kPa
在250℃,PCl5全部气化,并能部分解离为PCl3(g)和Cl2(g)。将4.16gPCl5置于1.00L容器中,在250℃全部气化之后,测定其总压力为113kPa,那么其中包含的气体有();它们的分压是()。
下列反应中△rSm值最大的是()A、PCl5(g)→PCl3(g)+Cl2(g)B、2SO2(g)+O2(g)→2SO3(g)C、3H2(g)+N2(g)→2NH3(g)D、C2H6(g)+3.5O2(g)→2CO2(g)+3H2O(l)
单选题反应PCl3(g)+Cl2(g)PC5(g),在298K时,,此温度下平衡时,如p(PCl5)=p(PCl3),则p(Cl2)=()。A130.38kPaB0.767kPaC7607kPaD7.67×10-3kPa